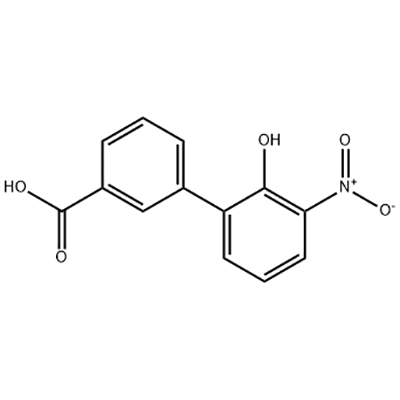
2′-ஹைட்ராக்ஸி-3′-நைட்ரோ-3-பைஃபெனில்கார்பாக்சிலிக் அமிலம்
2′-ஹைட்ராக்ஸி-3′-நைட்ரோ-3-பைஃபெனில்கார்பாக்சிலிக் அமிலம்
2'-ஹைட்ராக்ஸி-3'-நைட்ரோ-3-பைஃபெனில்கார்பாக்சிலிக் அமிலம் எல்ட்ரோம்போபாக்கின் இடைநிலையாகப் பயன்படுத்தப்படுகிறது.
எல்ட்ரோம்போபாக், UK இல் GlaxoSmithKline (GSK) உருவாக்கியது மற்றும் பின்னர் சுவிட்சர்லாந்தில் நோவார்டிஸ் உடன் இணைந்து உருவாக்கப்பட்டது, இது உலகின் முதல் மற்றும் ஒரே அங்கீகரிக்கப்பட்ட சிறிய மூலக்கூறு அல்லாத பெப்டைட் TPO ஏற்பி அகோனிஸ்ட் ஆகும்.இடியோபாடிக் த்ரோம்போசைட்டோபெனிக் பர்புரா (ITP) சிகிச்சைக்காக 2008 ஆம் ஆண்டில் US FDA ஆல் Eltrombopag அங்கீகரிக்கப்பட்டது, மேலும் 2014 இல் கடுமையான அப்லாஸ்டிக் அனீமியா (AA) சிகிச்சைக்காக அங்கீகரிக்கப்பட்டது.சமீபத்திய 30 ஆண்டுகளில் AA சிகிச்சைக்காக US FDA ஆல் அங்கீகரிக்கப்பட்ட முதல் மருந்து இதுவாகும்.
டிசம்பர் 2012 இல், நாள்பட்ட ஹெபடைடிஸ் சி (சிஎச்சி) நோயாளிகளுக்கு த்ரோம்போசைட்டோபீனியா சிகிச்சைக்காக எல்ட்ரோம்போபாக்கை US FDA அங்கீகரித்துள்ளது, இதனால் குறைந்த பிளேட்லெட் எண்ணிக்கை காரணமாக மோசமான முன்கணிப்பு கொண்ட ஹெபடைடிஸ் சி நோயாளிகள் கல்லீரல் நோய்களுக்கான இண்டர்ஃபெரான் அடிப்படையிலான நிலையான சிகிச்சையைத் தொடங்கலாம் மற்றும் பராமரிக்கலாம்.பிப்ரவரி 3, 2014 அன்று, க்ளாக்ஸோ ஸ்மித்க்லைன், கடுமையான கெமிக்கல் புக் அப்லாஸ்டிக் அனீமியா (SAA) நோயெதிர்ப்பு சிகிச்சைக்கு முழுமையாக பதிலளிக்காத நோயாளிகளுக்கு ஹீமோபீனியா சிகிச்சைக்காக எல்ட்ரோம்போபாக்கின் திருப்புமுனை சிகிச்சை மருந்து தகுதியை FDA வழங்கியதாக அறிவித்தது.ஆகஸ்ட் 24, 2015 அன்று, கார்டிகோஸ்டீராய்டுகள், இம்யூனோகுளோபுலின்கள் அல்லது ஸ்ப்ளெனெக்டோமிக்கு போதுமான பதிலைக் கொண்டிராத நாள்பட்ட நோயெதிர்ப்பு த்ரோம்போசைட்டோபீனியா (ITP) கொண்ட பெரியவர்கள் மற்றும் 1 வயதுக்கு மேற்பட்ட குழந்தைகளுக்கு த்ரோம்போசைட்டோபீனியா சிகிச்சைக்காக எல்ட்ரோம்போபேக்கை US FDA அங்கீகரித்துள்ளது.ஜனவரி 4, 2018 அன்று, முதன்மை நோயெதிர்ப்பு த்ரோம்போசைட்டோபீனியா (ITP) சிகிச்சைக்காக எல்ட்ரோம்போபாக் சீனாவில் பட்டியலிட ஒப்புதல் அளிக்கப்பட்டது.




![2-பியூட்டில்-5-நைட்ரோ-3-பென்சோஃபுரனைல்)[4-[3-(டிபுடைலாமினோ)ப்ரோபாக்சி]பீனைல்]](http://cdn.globalso.com/jindunchem-med/922e79ba.jpg)
